Data di ultimo aggiornamento 13 gennaio 2023
Italiano | English
Dal 1° maggio 2007 è obbligatoria la registrazione nella Banca Dati dei dispositivi medici con le modalità stabilite con il DM 21 dicembre 2009.
Sono esclusi dal decreto del 2009 i dispositivi su misura e i dispositivi medico-diagnostici in vitro . Sono inoltre esclusi i dispositivi destinati ad indagini cliniche.
Gli adempimenti relativi alla registrazione riguardano:
| Data immissione in commercio | Tipologia di Dispositivi medici | Sede del Fabbricante/Mandatario | Registrazione in Banca Dati |
|---|---|---|---|
| Antecedente il 1° maggio 2007 | DM di classe I, IIa, IIb, III e impiantabili attivi | Qualsiasi | Facoltativa se il dispositivo non è stato modificato dopo il 1° maggio 2007 con cambiamenti tali da necessitare una rinotifica |
| Successiva al 1° maggio 2007 | DM di classe I e assemblati | Altro Paese UE diverso dall’Italia | Facoltativa |
| Italia | Obbligatoria | ||
| DM di classe IIa, IIb, III e impiantabili attivi | Qualsiasi | Obbligatoria |
La Banca Dati/Repertorio (BD/RDM) costituisce una raccolta delle informazioni fornite dai:
Chiunque proceda alla notifica si assume la piena responsabilità riguardo alle informazioni fornite, sia in merito ai dati generali che a quelli relativi ai singoli dispositivi medici (DM).
La pubblicazione dei dati non configura alcuna forma di approvazione da parte del Ministero.
La Direzione Generale dei dispositivi medici e del servizio farmaceutico si riserva la facoltà di effettuare in ogni momento controlli su quanto dichiarato e sui dispositivi medici registrati, come previsto dal decreto legislativo 24 febbraio 1997, n.46 e successive modifiche.
Nella Banca Dati dei dispositivi medici, i soggetti che operano direttamente, inserendo i dati, si configurano come “dichiaranti”. Solo i soggetti dichiaranti possono modificare le informazioni relative a dispositivi medici da loro registrati.
Tutte le informazioni, inizialmente acquisite dal sistema nello stato di lavorazione “L”, devono essere "validate" attraverso la sottoscrizione tramite Firma Digitale per poter essere “pubblicate”.
A partire dal 1 gennaio 2014, relativamente allo stato di lavorazione (“L”), è entrato in vigore il limite temporale per il completamento delle notifiche dei dati. Il sistema applica un limite temporale diverso in relazione alla “Data Inizio Lavorazione”:
È inoltre possibile iscrivere il dispositivo, oltre che nella Banca Dati, anche nel repertorio dei dispositivi medici. L’iscrizione nel repertorio di un dispositivo medico non è obbligatoria ma facoltativa e gratuita.
L’iscrizione al repertorio consente, alle Regioni ed alle Province autonome di Trento e Bolzano nonché agli operatori del Servizio sanitario nazionale abilitati, la visibilità completa delle informazioni relative ai dispositivi medici iscritti.
A tale scopo è sufficiente selezionare il pulsante “Iscrizione nel repertorio”. Tale funzione si può attivare anche in un momento successivo alla validazione dei dati con Firma elettronica qualificata.
Per poter registrare i dispositivi in BD/RDM è necessario accedere alla Banca Dati secondo i percorsi definiti di seguito. L’azienda che opera direttamente nella BD/RDM si definisce “azienda dichiarante”; un’azienda dichiarante può essere:
Una volta ottenuto l’accesso, sarà possibile inserire i dati dei dispositivi.
Prima di poter procedere con la registrazione dei dispositivi medici, è necessario accedere alla Banca Dati dei dispositivi medici secondo le istruzioni riportate nella sezione precedente “Percorsi di accesso alla BD/RDM”.
Per le modalità di registrazione dei dispositivi medici si faccia riferimento alle istruzioni indicate nel Manuale Utente Profilo Fabbricante DM (pdf 8 MB). Si ricorda che l’obbligo o facoltà di registrazione dei dispositivi medici dipende dalla classe di rischio dei dispositivi medici e dalla sede dei soggetti responsabili all’immissione in commercio. Per approfondimenti si rimanda alla sezione Adempimenti per la registrazione.
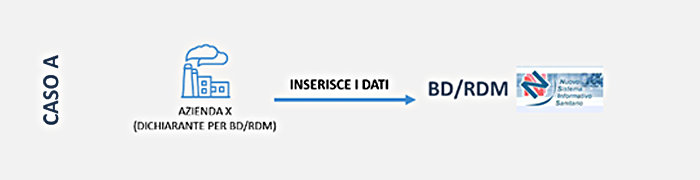
La tua azienda, in qualità di fabbricante, mandatario, assemblatore vuole accedere direttamente e quindi configurarsi come soggetto dichiarante nella BD/RDM.
Se la tua azienda ha sede in Italia: accedi alla Banca Dati tramite impresainungiorno.gov.it

L’acceso avviene attraverso il servizio on line Dispositivi medici, sul sito impresainungiorno.gov.it disponibile nella sezione Servizi integrati di impresa.gov - La mia scrivania.
È possibile accedere al servizio on-line tramite SPID (Sistema Pubblico di Identità Digitale), CIE (Carta di Identità Elettronica) o CNS (Carta Nazionale dei Servizi).
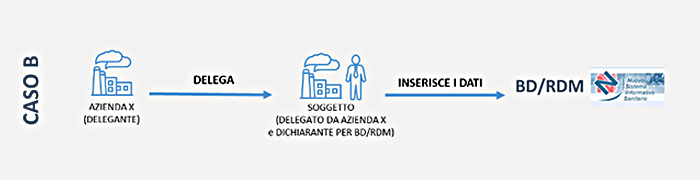
Sono direttamente autorizzati ad utilizzare il servizio i legali rappresentanti delle aziende interessate; peraltro il legale rappresentante di un’impresa può conferire ad una o più persone di sua fiducia la delega ad operare per suo conto per il servizio on line Dispositivi medici.
Per conferire la delega, il legale rappresentante deve utilizzare i servizi di gestione delle subdeleghe disponibili su portale per le imprese nella sezione Servizi integrati di impresainungiorno.gov.it – Gestione subdeleghe.
Al termine di questa procedura l’utente avrà disponibili le funzioni per la gestione dei dispositivi medici per i quali è delegato.
Per la registrazione di un dispositivo medico, il soggetto delegato deve disporre di una Firma elettronica qualificata rilasciata da uno dei certificatori autorizzati in Italia o conformi alle disposizioni del Regolamento EU No. 910/2014- The eIDAS (electronic IDentification Authentication and Signature).
Le istruzioni operative per l’inserimento dei dati sono riportate nel Manuale Utente Profilo Fabbricante DM (pdf 8 MB).
Se la tua azienda non ha sede in Italia: accedi alla Banca Dati inviando tramite email il modulo di richiesta delle credenziali di accesso.
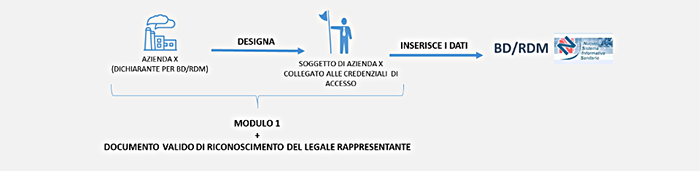
La procedura di richiesta delle credenziali di accesso prevede le fasi:
N.B. Anche se la tua azienda non è un fabbricante, ad esempio mandatario, il profilo che abilita la possibilità di inserire i dati dei dispositivi è denominato “FabbricanteDM”.
Per l’utilizzo del sistema e la registrazione di un dispositivo medico, il soggetto responsabile dell’inserimento dei dati nella BD/RDM deve disporre di una Firma elettronica qualificata rilasciata da uno dei certificatori autorizzati in Italia o conformi alle disposizioni del Regolamento EU No. 910/2014- The eIDAS (electronic IDentification Authentication and Signature) Regulation.
La tua azienda, in qualità di fabbricante, mandatario o assemblatore vuole delegare un altro soggetto ad accedere alla BD/RDM il quale si configura come soggetto dichiarante, responsabile dell’inserimento dei dati.
La delega può essere attribuita da un’azienda (delegante) nei confronti di:
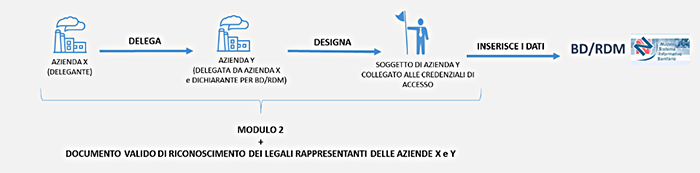
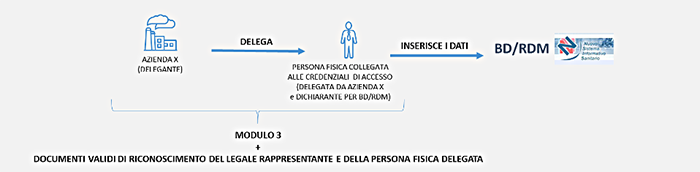
Azienda delegata e dichiarante italiana
Nel caso di azienda delegata e dichiarante italiana - la procedura di delega prevede le seguenti fasi:
Nel caso di azienda delegata e dichiarante straniera - la procedura di delega prevede le seguenti fasi:
N.B. Anche se la tua azienda non è un fabbricante, ad esempio mandatario o azienda delegata, il profilo che abilita la possibilità di inserire i dati dei dispositivi è denominato “FabbricanteDM”.
Per l’utilizzo del sistema e la registrazione di un dispositivo medico, il soggetto responsabile dell’inserimento dei dati nella BD/RDM deve disporre di una Firma elettronica qualificata rilasciata da uno dei certificatori autorizzati in Italia o conformi alle disposizioni del Regolamento EU No. 910/2014- The eIDAS (electronic IDentification Authentication and Signature) Regulation.
Nel caso di persona fisica delegata e dichiarante - la procedura di delega prevede le seguenti fasi:
N.B. Anche se in qualità di persona fisica delegata non si riveste il ruolo di fabbricante come previsto dalla normativa, il profilo che abilita la possibilità di inserire i dati dei dispositivi è denominato “FabbricanteDM”.
Per l’utilizzo del sistema e la registrazione di un dispositivo medico, il soggetto responsabile dell’inserimento dei dati nella BD/RDM deve disporre di una Firma elettronica qualificata rilasciata da uno dei certificatori autorizzati in Italia o conformi alle disposizioni del Regolamento EU No. 910/2014- The eIDAS (electronic IDentification Authentication and Signature) Regulation.
I dati già inseriti nel sistema possono essere modificati solo dal dichiarante che ha inserito i dati.
Per indicazioni operative per modificare i dati delle registrazioni dei dispositivi medici si faccia riferimento alle istruzioni indicate nel Manuale Utente Profilo Fabbricante DM (pdf 8 MB).
Nel caso di modifiche dei dati inseriti da un altro dichiarante, si invita a contattare il Servizio di Assistenza del Ministero della Salute: SupportoRDM - supportoRDM@sanita.fvg.it.
L'attività comporta delle attività di verifica di natura informatica/amministrativa i cui tempi sono variabili.
L’assistenza agli utenti è articolata in più servizi di assistenza specialistici distinti per tipologie di chiarimenti riguardanti:
Per assistenza e chiarimenti in merito all'accesso al sistema attraverso impresainungiorno.gov.it, utilizzato dalle aziende italiane, fare riferimento al sito impresa.gov.it.
Per quesiti ed assistenza in merito alle norme tecniche del procedimento ed alle modalità di attuazione della registrazione di un dispositivo nella Banca Dati e nel repertorio dei dispositivi medici ed alla variazione dei dati già inseriti nel sistema, il Servizio di Assistenza del Ministero della Salute, SupportoRDM, è disponibile al numero 040 3775666 nel seguente orario: dal lunedì al venerdì 9.00 - 13.00 escluso festivi. È possibile inviare la segnalazione anche al seguente indirizzo di posta elettronica: supportoRDM@sanita.fvg.it.
Per informazioni riguardanti le modalità d’accesso al sistema, d’uso dell’applicazione e le segnalazioni di casi di malfunzionamento delle procedure informatiche è possibile rivolgersi al nuovo Service Desk del Ministero della Salute telefonando al numero verde 800178178 nel seguente orario:
dal lunedì alla domenica (H24 7/7), incluse le festività.
È possibile inviare la segnalazione anche al seguente indirizzo di posta elettronica: servicedesk.salute@smi-cons.it