Data di ultimo aggiornamento 7 febbraio 2024
Dal 26 novembre 2017 (cfr. art. 120, paragrafo 3, lettera a del Regolamento (UE) 2017/745 e art. 113, paragrafo 3, lettera b del Regolamento (UE) 2017/746) sono applicabili le disposizioni che riguardano gli Organismi che vogliono operare ai sensi del Regolamento (UE) 2017/745, nel settore dei dispositivi medici e ai sensi del Regolamento (UE) 2017/746, nel settore dei dispositivi medico-diagnostici in vitro.
A tal proposito, ai fini della designazione e della successiva notifica, gli Organismi di valutazione della conformità (Conformity Assessment Body - CAB), per ottenere l’autorizzazione ad espletare le valutazioni della conformità come Organismo notificato ai sensi del Regolamento (UE) 2017/745, devono presentare all’Ufficio 3 della Direzione generale dei dispositivi medici e del servizio farmaceutico (DGDMF) del Ministero della salute, una domanda, ai sensi dell’articolo 38, corredata della prevista documentazione.
Gli Organismi di valutazione della conformità (Conformity Assessment Body – CAB) che intendano ottenere la designazione come organismo notificato, incaricato di svolgere attività di valutazione della conformità a norma del Regolamento (UE) 2017/746, devono presentare all’Ufficio 4 della Direzione generale dei dispositivi medici e del servizio farmaceutico (DGDMF) del Ministero della Salute, una domanda ai sensi dell’articolo 34 del medesimo Regolamento, corredata della prevista documentazione.
Le domande e la relativa documentazione dovranno pervenire all’indirizzo di posta certificata dgfdm@postacert.sanita.it oppure, qualora le dimensioni dei file non lo consentano, per posta raccomandata AR all’indirizzo Viale Giorgio Ribotta, 5 - 00144 Roma.
In alternativa, la domanda e la relativa documentazione potranno essere consegnate a mano presso il medesimo indirizzo.
Il processo di valutazione dell’Organismo finalizzato alla designazione è un processo complesso e articolato, che vede il coinvolgimento, oltre che del Ministero della salute in veste di Autorità responsabile per gli Organismi notificati (Designating Authority - DA), anche di un gruppo di valutazione congiunto (Joint Assessment Team – JAT), formato da rappresentanti della Commissione Europea e da esperti nazionali di altri Stati Membri dell’Unione europea, diversi da quello della DA.
La Designazione e la successiva notifica in NANDO sono subordinate all’opinione finale (final opinion) del JAT e alla Raccomandazione del Gruppo di Coordinamento per i Dispositivi Medici (MDCG). Nella figura sono individuati gli step relativi al processo.
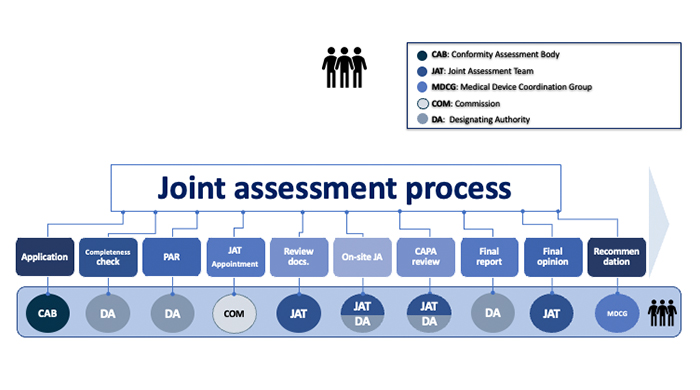
L’Autorità Designante, sulla base della Raccomandazione del gruppo MDCG, adotta il decreto di autorizzazione, in cui si specifica lo scopo della designazione, indicando le attività di valutazione della conformità, nonché la tipologia dei dispositivi medici/dispositivi medico-diagnostici in vitro, che l’Organismo è autorizzato a valutare ed eventuali altre condizioni connesse alla stessa designazione.
L’identificazione delle tipologie dei dispositivi medici e dei dispositivi medico-diagnostici in vitro avviene sulla base dei codici presenti nel Regolamento di esecuzione (UE) 2017/2185 della Commissione del 23 novembre 2017.
La domanda di designazione dovrà essere accompagnata dalla ricevuta di pagamento della tariffa di euro 11.247,96 da effettuarsi sul c/c intestato a Tesoreria Provinciale di Viterbo n. 60413416; IBAN IT24F0760114500000060413416.
Infatti, fino a nuove disposizioni da parte della Direzione Generale, per le attività effettuate dal Ministero della salute finalizzate alla designazione, al monitoraggio e alla rivalutazione degli Organismi notificati ai sensi del Regolamento (UE) 2017/745 e del Regolamento (UE) 2017/746 si applicano le tariffe stabilite nel Decreto 14 luglio 2004, recante: «Determinazione delle tariffe per i servizi resi dal Ministero della salute e relative modalità di pagamento, ai sensi dell’art. 47 della legge 6 febbraio 1996, n. 52» come modificato dal Decreto 18 febbraio 2015.
Il fabbricante può rivolgersi a qualsiasi Organismo notificato designato in Italia o in un altro Paese dell’Unione europea, a sua scelta. Per l'elenco completo degli Organismi notificati designati in Europa si rimanda alla consultazione del sistema informativo NANDO New Approach Notified and Designated Organisations.
Le linee guida del gruppo MDCG, che forniscono linee di indirizzo comune in tutti gli Stati Membri dell’UE, anche in relazione alle attività degli Organismi notificati, sono disponibili sul sito dell'Unione europea alla pagina Guidance - MDCG endorsed documents and other guidance.
Per ulteriori informazioni relative al settore dei dispositivi medici, contattare l’Ufficio 3 della Direzione generale dei dispositivi medici e del servizio farmaceutico.
Per ulteriori informazioni relative al settore dei dispositivi medico-diagnostici in vitro, contattare l’Ufficio 4 della Direzione generale dei dispositivi medici e del servizio farmaceutico.
email dgfdm@postacert.sanita.it
No. 0051 - IMQ S.p.A.
Via Quintiliano, 43
20138 MILANO
Tel.: ++39 02 50731
Fax: ++39 02 50991500
Decreto di autorizzazione 19 luglio 2019
Decreto di proroga 20 luglio 2022
No. 0373 - ISTITUTO SUPERIORE DI SANITA'
Viale Regina Elena, 299 00161 ROMA
Tel.: ++39 06 49903341 - 49902915
Fax: ++39 06 49387068 - 49387075
Decreto di autorizzazione 13 gennaio 2021
Decreto di proroga 12 gennaio 2024
No. 0425 - ICIM S.p.A.
Piazza Don Enrico Mapelli, 75
20099 SESTO SAN GIOVANNI (MI)
Tel. ++39 02 725341
Fax ++39 02 72002098
Decreto di autorizzazione 2 novembre 2022
No. 0426 - ITALCERT
Viale Sarca 336
20126 MILANO
Tel.: +39 02 66104876
Fax : +39 02 66101479
Decreto di autorizzazione 10 dicembre 2021
No. 0476 - KIWA CERMET ITALIA S.P.A.
Via Cadriano, 23
40057 Granarolo dell’Emilia (Bo)
Tel. +39 051 459 3111
Fax +39 051763382.
Via Giacomo Matteotti, 9
40057 Granarolo dell’Emilia (Bo)
Tel. +39 051 459 3111
Fax +39 051763382.
Via Fabio Filzi, 68
20032. Cormano (Mi)
Tel. +39 051 459 3111
Fax +39 051763382
Tepeoren Itosb Mah, 9
§Cad. 15 Tuzla/Istanbul Turchia
Tel. +90 216 593 25 75
Decreto di autorizzazione 11 giugno 2021
No. 0477 – Eurofins Product Testing Italy S.r.l.
Via Cuorgnè, 21
10156 TORINO
tel.: +39 011 2222225
fax: +39 011 2222226
Decreto di autorizzazione 17 giugno 2021
No. 0546 - CERTIQUALITY
Via Gaetano Giardino 4
20123 Milano
Tel: 02.80691789
Fax: +39 02 86465295
Via delle industrie, 17/A
Edificio Lybra c/o Parco Scientifico e Tecnologico
30175, Marghera Venezia
Tel. 041.0991302
Via Ettore Cristoni, 80
40033, Casalecchio di Reno - Bologna
Tel. 051.5872175
Via Francesco Benaglia, 13
00153, Roma
Tel. 06.97271106
Via G. Porzio
Centro Direzionale, Isola E/2
Pal. Futura (scala A) - 3° piano
80143, Napoli
Tel. 081.5628494
Corso Italia 13
c/o centro ufficio Verga
95129, Catania
Tel. 095.497087
Via S. Matarrese, 4
70124, Bari
Tel. 080.5046136
Decreto di autorizzazione 17 settembre 2021
No. 1282 – Ente Certificazione Macchine S.r.l.
Via Ca’ Bella, 243
40053 VALSAMOGGIA (BO) - Località Castello di Serravalle
Tel.+39 051 6705141
Fax+39 051 6705156
Decreto di autorizzazione 9 settembre 2022
No. 1370 – Bureau Veritas Italia S.p.A.
Via Monza, 347
20126 – MILANO
Tel. +39.02.270911
Fax +39.02 2552980
Decreto di autorizzazione 30 giugno 2022
No. 1936 - TÜV Rheinland Italia srl
Via Mattei, 3
20005 POGLIANO MILANESE (Mi)
Tel. +39 02 939687331
Fax +39 02 93968723
Decreto di autorizzazione 3 agosto 2021
Si tratta di Organismi che sono stati autorizzati dalle Autorità Designanti (Autorità responsabili per gli Organismi notificati) ad espletare le procedure di valutazione della conformità dei dispositivi, ai fini della marcatura CE, da apporre ai sensi delle Direttive sui dispositivi medici e sui dispositivi medico-diagnostici in vitro.
L’autorizzazione è relativa alle procedure di valutazione e alle tipologie di dispositivi indicate nello scopo della designazione.
Gli Organismi notificati ai sensi delle Direttive risultano ancora presenti nel sistema informativo NANDO (New Approach Notified and Designated Organisations) ma le loro notifiche, ai sensi delle Direttive, sono evidenziate dal segnale di warning:
As from the 26 May 2021, the notified body is no longer able to issue new certificates under Directive 93/42/EEC, but only allowed to carry out surveillance activities for certificates validly issued under Directive in the transitional period, as established in article 120 of Regulation (EU) 2017/745.
As from 26 May 2022, the notified bodies designated under Directive 98/79/EC as listed here are no longer able to issue new certificates under that Directive, but only allowed to carry out surveillance activities for certificates validly issued under that Directive in the transitional period, as established in Article 110 of Regulation (EU) 2017/746
Infatti, a partire dal 26 maggio 2021 per i dispositivi medici e dal 26 maggio 2022 per i dispositivi medico-diagnostici in vitro, gli Organismi notificati designati ai sensi delle Direttive non sono più autorizzati a rilasciare nuovi certificati ai sensi delle Direttive sui dispositivi medici e sui dispositivi medico-diagnostici in vitro. Tuttavia, l’Organismo notificato che ha legittimamente rilasciato una certificazione ai sensi delle Direttive prima del 26 maggio 2021 o del 26 maggio 2022, continua ad essere responsabile dell’appropriata sorveglianza dei dispositivi che ha certificato; ciò indipendentemente dal fatto che l’Organismo in questione abbia presentato o meno un’istanza per essere designato ai sensi del Regolamento (UE) 2017/745 o del Regolamento (UE) 2017/746 e/o abbia una designazione ancora valida ai sensi delle Direttive durante il periodo di validità dei certificati rilasciati secondo le Direttive sui dispositivi medici e sui dispositivi medico-diagnostici in vitro.
L’Organismo è tenuto a svolgere regolarmente le attività di sorveglianza, inclusa quella in loco, con e senza preavviso, e quella relativa al monitoraggio dei cambiamenti significativi. Nello svolgimento delle proprie attività di sorveglianza sui certificati rilasciati ai sensi delle Direttive, l’Organismo è soggetto, a sua volta, alla sorveglianza da parte del Ministero della salute, in qualità di Autorità responsabile per gli organismi notificati. Pertanto, per quanto riguarda i dispositivi medici, fino al 27 maggio 2024, continua ad applicarsi il Regolamento di esecuzione (UE) n. 920/2013 della Commissione limitatamente alle prescrizioni relative alle attività di sorveglianza e monitoraggio degli Organismi notificati.
Non vige alcun obbligo per le Autorità responsabili degli organismi notificati di implementare procedure di rinnovo delle designazioni ai sensi delle Direttive dopo il 26 maggio 2021 o dopo il 26 maggio 2022.
No. 0051 - IMQ S.p.A.
Via Quintiliano, 43
20138 MILANO
Tel.: ++39 02 50731
Fax: ++39 02 50991500
Decreto di autorizzazione 22 febbraio 2007
Decreto di rinnovo ed estensione dell’autorizzazione 11 maggio 2012
Decreto di autorizzazione 8 maggio 2017
No. 0068 - MTIC InterCert S.r.l.
sede legale: via Giacomo Leopardi, 14
20123 MILANO
sede amministrativa e laboratori: Via Moscova, 11
20017 Rho (MI)
Tel.: ++39 02 97071800
Fax: ++39 02 9308176
Decreto di autorizzazione 10 settembre 2007
Decreto di rinnovo ed estensione dell'autorizzazione 7 gennaio 2013
Decreto di autorizzazione 22 dicembre 2017
Decreto di limitazione 12 marzo 2021
No. 0373 - ISTITUTO SUPERIORE DI SANITA'
Viale Regina Elena, 299
00161 ROMA
Tel.: ++39 06 49903341 - 49902915
Fax: ++39 06 49387068 - 49387075
Decreto di autorizzazione 12 novembre 2009 - Dispositivi medico-diagnostici in vitro
Decreto di rinnovo ed estensione dell’autorizzazione 22 ottobre 2015 - Dispositivi medico-diagnostici in vitro
Decreto di autorizzazione 5 luglio 2017
Decreto di rinnovo ed estensione dell'autorizzazione 22 ottobre 2020 - Dispositivi medico-diagnostici in vitro
No. 0425 - ICIM S.p.A.
Piazza Don Enrico Mapelli, 75
20099 SESTO SAN GIOVANNI (MI)
Tel. ++39 02 725341
Fax ++39 02 72002098
Decreto di autorizzazione 20 gennaio 2005
Decreto di rinnovo ed estensione dell'autorizzazione 16 febbraio 2011
Decreto di autorizzazione temporanea 3 marzo 2016
Decreto di autorizzazione 9 settembre 2016
No. 0426 - ITALCERT
Viale Sarca 336
20126 MILANO
Tel.: +39 02 66104876
Fax : +39 02 66101479
Decreto di autorizzazione 1 dicembre 2006
Decreto di modifica dell'autorizzazione 10 settembre 2007
Decreto di modifica all'autorizzazione 8 aprile 2010
Decreto di rinnovo ed estensione dell’ autorizzazione 15 febbraio 2012
Decreto di rinnovo ed estensione dell’autorizzazione del 3 marzo 2017
No. 0476 - KIWA CERMET ITALIA S.P.A.
Via Cadriano, 23
40057 Granarolo dell’Emilia (Bo)
Tel. +39 051 459 3111
Fax +39 051763382.
Via Giacomo Matteotti, 9
40057 Granarolo dell’Emilia (Bo)
Tel. +39 051 459 3111
Fax +39 051763382.
Via Fabio Filzi, 68
20032. Cormano (Mi)
Tel. +39 051 459 3111
Fax +39 051763382
Decreto di autorizzazione 12 novembre 2007
Decreto di modifica dell'autorizzazione 8 aprile 2010
Decreto di autorizzazione 21 marzo 2011
Decreto di rinnovo ed estensione dell'autorizzazione 12 febbraio 2013
Decreto di autorizzazione temporanea 12 febbraio 2018
Decreto di rinnovo ed estensione dell’autorizzazione 22 marzo 2018
No. 0477 – Eurofins Product Testing Italy S.r.l.
Via Cuorgnè, 21
10156 TORINO
tel.: +39 011 2222225
fax: +39 011 2222226
Decreto di autorizzazione 10 settembre 2007
Decreto di autorizzazione 18 luglio 2011
Decreto di rinnovo ed estensione dell'autorizzazione 17 aprile 2013
Decreto di autorizzazione temporanea 16 aprile 2018
Decreto di rinnovo ed estensione dell’autorizzazione 12 ottobre 2018
No. 0546 - CERTIQUALITY
Via Gaetano Giardino 4
20123 Milano
Tel: 02.80691789
Fax: +39 02 86465295
Via delle industrie, 17/A
Edificio Lybra c/o Parco Scientifico e Tecnologico
30175, Marghera Venezia
Tel. 041.0991302
Via Ettore Cristoni, 80
40033, Casalecchio di Reno - Bologna
Tel. 051.5872175
Via Francesco Benaglia, 13
00153, Roma
Tel. 06.97271106
Via G. Porzio
Centro Direzionale, Isola E/2
Pal. Futura (scala A) - 3° piano
80143, Napoli
Tel. 081.5628494
Corso Italia 13
c/o centro ufficio Verga
95129, Catania
Tel. 095.497087
Via S. Matarrese, 4
70124, Bari
Tel. 080.5046136
Decreto di autorizzazione 1 dicembre 2006
Decreto di ulteriore autorizzazione 5 giugno 2009
Decreto di rinnovo ed estensione dell’autorizzazione 27 marzo 2012
Decreto di autorizzazione temporanea 5 aprile 2017
Decreto di rinnovo ed estensione dell’autorizzazione del 7 agosto 2017
No. 1282 – Ente Certificazione Macchine S.r.l.
Via Ca’ Bella, 243
40053 VALSAMOGGIA (BO) - Località Castello di Serravalle
Tel. +39.051.6705141
Fax +39.051.6705156
Decreto di autorizzazione del 2 febbraio 2017
No. 1370 – Bureau Veritas Italia S.p.A.
Via Monza, 347
20126 – MILANO
Tel. +39.02.270911
Fax +39.02 2552980
Decreto di autorizzazione del 27 settembre 2013
Decreto di autorizzazione temporanea 26 settembre 2018
Decreto di autorizzazione temporanea 26 marzo 2019
Decreto di rinnovo ed estensione dell’autorizzazione 5 aprile 2019
No. 1936 - TÜV Rheinland Italia srl
Via Mattei, 3
20005 POGLIANO MILANESE (Mi)
Tel. +39 02 939687331
Fax +39 02 93968723
Decreto di autorizzazione 26 giugno 2007
Decreto di modifica di autorizzazione 7 settembre 2011
Decreto di rinnovo ed estensione dell'autorizzazione 9 gennaio 2013
Decreto di rinnovo ed estensione dell’autorizzazione 8 gennaio 2018
Consulta l'elenco degli Organismi notificati in Italia sul sito dell'Unione europea alla pagina Notified bodies Nando