Data di ultimo aggiornamento 14 marzo 2024
Italiano | English

Il Regolamento (UE) 2017/746 (IVDR) prevede, agli articoli 26 e 28 rispettivamente, la registrazione dei dispositivi e degli operatori economici nella Banca dati europea Eudamed.
In attesa della piena funzionalità di Eudamed, al momento in Italia permangono gli obblighi previsti dall’art. 10 del Decreto legislativo 332/2000, il quale è abrogato decorsi ventiquattro mesi dalla data di pubblicazione dell’avviso sulla operatività di Eudamed.
La registrazione di un dispositivo medico-diagnostico in vitro all’interno del sistema Banca Dati/Repertorio dei Dispositivi Medici può essere richiesta da:
Il soggetto che effettua direttamente le operazioni nella Banca Dati/Repertorio dei Dispositivi Medici si configura come Dichiarante ed è sempre una persona fisica (italiana o non). Solo i soggetti dichiaranti, in quanto responsabili della comunicazione informatica, possono modificare le informazioni relative ai dispositivi medico-diagnostici in vitro già notificati.
Il Dichiarante può essere:
L’accesso alla Banca Dati/Repertorio dei Dispositivi Medici è stato distinto in due percorsi, a seconda che l'azienda che effettua la registrazione abbia o meno una sede legale in Italia:
I soggetti dichiaranti, già abilitati ad accedere alla Banca Dati/Repertorio dei Dispositivi Medici e già in possesso del ruolo di “FabbricanteIVD”, potranno utilizzare le medesime credenziali per l’accesso, ma dovranno disporre della delega per la registrazione dei dispositivi medico-diagnostici In vitro da parte di ogni fabbricante/mandatario.
Le istruzioni operative per la registrazione dei dispositivi medico-diagnostici in vitro sono riportate nel Manuale Utente Profilo Fabbricante (pdf 9 MB).
Nel caso in cui il Fabbricante, o il Mandatario, o il soggetto Delegato, sia un’impresa italiana e intenda effettuare direttamente la registrazione, dovrà seguire le indicazioni riportate in questa sezione.
Le imprese italiane accedono al Repertorio dei Dispositivi Medici attraverso il servizio on line Dispositivi medici, disponibile sul Portale per le imprese, nella sezione Servizi integrati di impresa.gov - La mia scrivania.
Sono direttamente autorizzati ad utilizzare il servizio i legali rappresentanti delle imprese interessate; peraltro il legale rappresentante di un’impresa può conferire ad una o più persone di sua fiducia la delega ad operare per suo conto con il servizio on line Dispositivi medici.
Per conferire la delega, il legale rappresentante deve utilizzare i servizi di gestione subdeleghe disponibili sul Portale per le imprese, nella sezione Servizi integrati di impresa.gov – Gestione subdeleghe.
Al termine di questa procedura l’utente abilitato avrà disponibili le funzioni per la gestione dei dispositivi per i quali è delegato.
La smart card per le aziende italiane
L’accesso al servizio on line è consentito a chi è titolare di una smart card (tipo SPID-Sistema Pubblico di Identità Digitale, CIE-Carta di Identità Elettronica o CNS-Carta Nazionale dei Servizi), sia i rappresentanti legali che eventuali delegati debbono essere titolari di una propria smart card.
La smart card è una tessera elettronica predisposta per contenere certificati digitali. Il certificato digitale è un vero e proprio documento di identità in formato elettronico che, attestando l’identità del possessore, consente di effettuare nel mondo "virtuale" tutte le operazioni che richiedono il riconoscimento del titolare. A differenza del mondo reale, i certificati digitali vengono generati definendone preventivamente lo scopo specifico: di conseguenza i certificati utilizzabili per apporre firme elettroniche sono diversi dai certificati utilizzabili per effettuare l’autenticazione in rete.
I diversi tipi di certificato, presenti anche su un‘unica smart card, sono:
L’utente abilitato ad utilizzare il servizio on line Dispositivi medici, attraverso il Portale per le imprese, deve disporre di una smart card che contenga sia il certificato digitale di autenticazione, sia il certificato digitale di firma.
L’utilizzo della smart card richiede una specifica configurazione del browser: le relative indicazioni tecniche dipendono dal tipo di smart card utilizzata e vengono normalmente comunicate dal fornitore della smart card stessa.
Le smart card possono essere richieste ad uno dei Certificatori accreditati, il cui elenco è disponibile sul sito del DigitPA nella sezione Firma digitale - Certificatori accreditati.
Ulteriori modalità per la registrazione di imprese italiane nella Banca Dati/Repertorio dei Dispositivi Medici che non prevedono l’accesso tramite Portale per le imprese sono:
Le imprese estere possono registrare direttamente i dispositivi nella Banca Dati/Repertorio dei Dispositivi (BD/RDM) Medici utilizzando le funzioni on line, disponibili sia in lingua italiana che in lingua inglese.
Per la registrazione:
Per la registrazione da parte di un’impresa estera si configurano i casi:
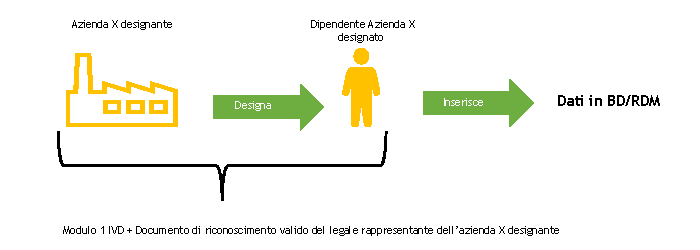
ll rappresentante legale dell’azienda designante deve compilare il MODULO 1-IVD e inviarlo al Ministero della Salute.
Il Ministero della Salute, a seguito della ricezione del MODULO 1-IVD ne appura la completezza.
A seguito di tale controllo, il Ministero della Salute registra il soggetto designato a operare nella BD/RDM come utente del Sistema di Sicurezza del NSIS (Nuovo Sistema Informatico Sanitario) e lo abilita al profilo di FabbricanteIVD.
Il soggetto designato a operare nella BD/RDM riceverà, all’indirizzo di posta elettronica indicato nel MODULO 1-IVD, due e-mail automatiche:
Se il soggetto responsabile dell’inserimento dei dati nella BD/RDM è già in possesso delle credenziali di accesso, riceverà solo la seconda e-mail automatica o nessuna, nel caso in cui abbia anche il ruolo FabbricanteIVD.
Al termine di questa procedura per l’utente abilitato saranno disponibili le funzioni per inserire nella BD/RDM i dati dei dispositivi. Le istruzioni operative per la registrazione dei Dispositivi medici sono riportate nel Manuale Utente Profilo Fabbricante (pdf, 9 Mb).
Per l’utilizzo del sistema è necessario che il soggetto designato disponga di un certificato di Firma elettronica qualificata rilasciata da uno dei certificatori autorizzati in Italia o conformi alle disposizioni del Regolamento EU No. 910/2014- The eIDAS (electronic IDentification Authentication and Signature). Il formato dei dati firmati deve essere conforme allo standard PKCS #7.
Le imprese estere devono utilizzare la firma off-line per agevolare l’acquisizione nel sistema dei file firmati elettronicamente. Qualora, effettuando tale operazione, dovessero presentarsi problemi l’utente potrà contattare il servicedesk.salute@smi-cons.it per le necessarie verifiche.
L’utente sarà contattato per e-mail da servicedesk.salute@smi-cons.it per le necessarie verifiche, al termine delle quali riceverà una e-mail per informarlo che può iniziare ad utilizzare la firma elettronica in modalità off-line per la validazione dei dati inseriti.
Anche se l’azienda non è un fabbricante, ad esempio mandatario, il profilo che abilita la possibilità di inserire i dati dei dispositivi è denominato “FabbricanteIVD”.
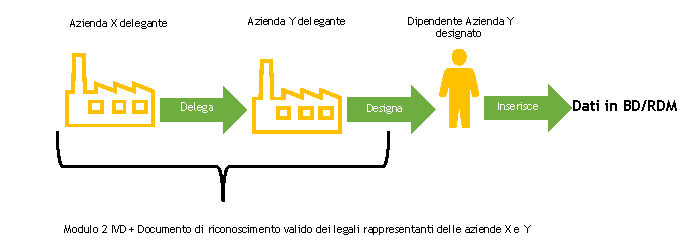
L’azienda delegante e l’azienda delegata e dichiarante devono compilare, ciascuna per le parti di propria competenza, il MODULO 2-IVD e inviarlo al Ministero della Salute.
Il Ministero della Salute, a seguito della ricezione del MODULO 2-IVD ne appura la completezza.
Nel caso di azienda delegata e dichiarante italiana la stessa dovrà procedere seguendo le indicazioni riportate nella pagina Imprese italiane.
Nel caso di azienda delegata e dichiarante straniera, a seguito del controllo del modulo, il Ministero della Salute procederà alla registrazione del soggetto designato a operare nella BD/RDM come utente del Sistema di Sicurezza del NSIS e lo abilita al profilo di FabbricanteIVD.
Il soggetto designato a operare nella BD/RDM riceverà all’indirizzo di posta elettronica indicato nel MODULO 2-IVD due e-mail automatiche:
Se il soggetto responsabile dell’inserimento dei dati nella BD/RDM è già in possesso delle credenziali di accesso, riceverà solo la seconda email automatica o nessuna, nel caso in cui abbia anche il ruolo FabbricanteIVD.
L’azienda delegata e dichiarante inserisce nella banca dati dei dispositivi medici il modulo di delega debitamente compilato, seguendo le indicazioni descritte nella sezione “Acquisizione Deleghe” del Manuale Utente Profilo Fabbricante (pdf, 9 Mb).
Al termine di questa procedura per l’utente abilitato saranno disponibili le funzioni per inserire i dati dei dispositivi per cui ha delega nella banca dati. Le istruzioni operative per la registrazione dei Dispositivi Medici sono riportate nel Manuale Utente Profilo Fabbricante (pdf, 9 Mb).
Per l’utilizzo del sistema è necessario che il soggetto designato disponga di un certificato di Firma elettronica qualificata rilasciata da uno dei certificatori autorizzati in Italia o conformi alle disposizioni del Regolamento EU No. 910/2014- The eIDAS (electronic IDentification Authentication and Signature). Il formato dei dati firmati deve essere conforme allo standard PKCS #7.
Le imprese estere devono utilizzare la firma off-line per agevolare l’acquisizione nel sistema dei file firmati elettronicamente. Qualora, effettuando tale operazione, dovessero presentarsi problemi l’utente potrà contattare il servicedesk.salute@smi-cons.it per le necessarie verifiche.
L’utente sarà contattato per e-mail da servicedesk.salute@smi-cons.it per le necessarie verifiche, al termine delle quali riceverà una e-mail per informarlo che può iniziare ad utilizzare la firma elettronica in modalità off-line per la validazione dei dati inseriti.
Anche se l’azienda non è un fabbricante, ad esempio mandatario o altra azienda delegata, il profilo che abilita la possibilità di inserire i dati dei dispositivi è denominato “FabbricanteIVD”.
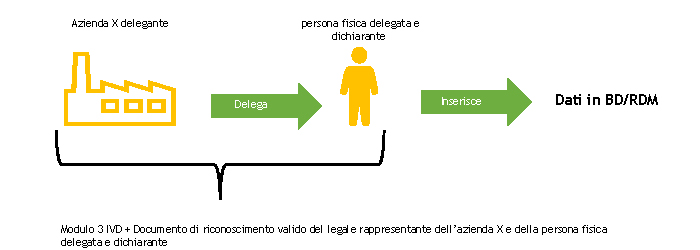
L’azienda delegante e la persona fisica delegata e dichiarante devono compilare, ciascuno per le parti di propria competenza, il MODULO 3-IVD e inviarlo al Ministero della Salute.
Il Ministero della Salute, a seguito della ricezione del MODULO 3 -IVD ne appura la completezza.
A seguito di tale controllo, il Ministero della Salute registra il soggetto designato a operare nella BD/RDM come utente del Sistema di Sicurezza del NSIS e lo abilita al profilo di FabbricanteIVD.
La persona fisica delegata e dichiarante a operare nella BD/RDM riceverà all’indirizzo di posta elettronica indicato nel MODULO 3-IVD due email automatiche:
Se il soggetto responsabile dell’inserimento dei dati nella BD/RDM è già in possesso delle credenziali di accesso, riceverà solo la seconda email automatica o nessuna, nel caso in cui abbia anche il ruolo FabbricanteIVD.
La persona fisica delegata e dichiarante inserisce nella banca dati dei dispositivi medici il modulo di delega debitamente compilato, seguendo le indicazioni descritte nella sezione “Acquisizione Deleghe” del Manuale Utente Profilo Fabbricante (pdf, 9 Mb).
Al termine di questa procedura per l’utente abilitato saranno disponibili le funzioni per inserire i dati dei dispositivi per cui ha delega nella banca dati. Le istruzioni operative per la registrazione dei Dispositivi Medici sono riportate nel Manuale Utente Profilo Fabbricante (pdf, 9 Mb).
Per l’utilizzo del sistema è necessario che il soggetto designato disponga di un certificato di Firma elettronica qualificata rilasciata da uno dei certificatori autorizzati in Italia o conformi alle disposizioni del Regolamento EU No. 910/2014- The eIDAS (electronic IDentification Authentication and Signature). Il formato dei dati firmati deve essere conforme allo standard PKCS #7.
La persona fisica deve utilizzare la firma off-line per agevolare l’acquisizione nel sistema dei file firmati elettronicamente. Qualora, effettuando tale operazione, dovessero presentarsi problemi l’utente potrà contattare il servicedesk.salute@smi-cons.it per le necessarie verifiche.
L’utente sarà contattato per e-mail da servicedesk.salute@smi-cons.it per le necessarie verifiche, al termine delle quali riceverà una e-mail per informarlo che può iniziare ad utilizzare la firma elettronica in modalità off-line per la validazione dei dati inseriti.
Anche se la persona fisica non è un fabbricante il profilo che abilita la possibilità di inserire i dati dei dispositivi è denominato “FabbricanteIVD”.
Chiunque proceda alla notifica si assume la piena responsabilità riguardo alle informazioni fornite, sia in merito ai dati generali che a quelli relativi ai singoli dispositivi medico-diagnostici in vitro.
La pubblicazione dei dati non configura alcuna forma di approvazione da parte del Ministero della Salute.
La Direzione generale dei dispositivi medici e del servizio farmaceutico si riserva la facoltà di effettuare in ogni momento controlli su quanto dichiarato e sui dispositivi iscritti.
Tutte le informazioni, inizialmente acquisite dal sistema nello stato di lavorazione “L”, devono essere "validate" attraverso la sottoscrizione con Firma Digitale per poter essere “pubblicate”.
L’attività di registrazione relativa a ciascun dispositivo prevede un tempo massimo per il completamento: una volta iniziata la lavorazione nel Repertorio il sistema consente il mantenimento dello stato “lavorazione” (“L”) per un periodo di tempo differente secondo i seguenti casi:
Qualora il sistema rilevi la presenza in Banca Dati di notifiche nello stato di lavorazione, le stesse sono elencate nella relativa sezione: Notifiche da completare (To-do List).
I dati presenti in Banca Dati/Repertorio dei Dispositivi Medici (BD/RDM) possono essere modificati solo dal soggetto designato come responsabile della comunicazione informatica, ovvero il dichiarante.
Il supporto agli utenti è articolato in più servizi di assistenza specialistici per tipologie di problemi e chiarimenti.
Assistenza per l'accesso al sistema attraverso il Portale delle imprese
Sul Portale delle imprese, si possono trovare assistenza e chiarimenti in merito all'accesso attraverso il servizio on line “Dispositivi Medici” del Portale e in merito al reperimento e all’uso della smart card.
Assistenza per la registrazione dei dispositivi
Per ulteriori informazioni inviare una comunicazione all'indirizzo di posta elettronica certificata dgdmf@postacert.sanita.it, specificando in oggetto Ufficio 4 – Dispositivi medico diagnostici in vitro.
Per questioni relative all’uso della sezione “Dati Azienda” è possibile rivolgersi anche al Servizio di Assistenza Telefonica disponibile al numero 040 3775666 nel seguente orario:
oppure all'indirizzo di posta elettronica: supportoRDM@sanita.fvg.it.
Assistenza tecnica - Service Desk
Per informazioni riguardanti le modalità d’accesso al sistema tramite piattaforma NSIS, l’uso dell’applicazione e le segnalazioni di casi di malfunzionamento delle procedure informatiche è possibile rivolgersi al Service Desk del Ministero della Salute: