L’etichetta rappresenta il mezzo attraverso il quale le informazioni sul prodotto sono veicolate all’utilizzatore finale e deve perciò essere redatta in modo preciso e corretto per garantire ai consumatori la possibilità di operare una scelta consapevole, basata su un adeguato livello di informazione circa le caratteristiche, la composizione e la funzione del prodotto cosmetico.
L’etichetta di un cosmetico deve essere redatta conformemente all’articolo 19 del Regolamento (CE) n. 1223/2009 del Parlamento europeo e del Consiglio.
Per i prodotti immessi sul mercato in Italia l’etichetta è in lingua italiana. Sono consentite indicazioni che utilizzino espressioni non in lingua italiana divenute di uso comune come ad esempio “shampoo”.
È possibile prevedere etichette multilingua, ma in questo caso per i prodotti destinati al mercato italiano almeno alcune informazioni devono comparire obbligatoriamente anche in lingua italiana e con dimensione dei caratteri di stampa equivalenti a quelle dei testi che figurano in altre lingue.
Devono essere riportate in lingua italiana le informazioni:
-
per i prodotti commercializzati in Italia con etichetta multilingua (articolo 19, paragrafo 1, lettere b),c),d) e f) del Regolamento 1223/2009):
- contenuto nominale al momento del confezionamento, espresso in peso o in volume
- data fino alla quale il prodotto cosmetico continuerà a svolgere la sua funzione iniziale
- precauzioni particolari per l’impiego
-
funzione del prodotto cosmetico
-
per i prodotti che, per dimensioni ridotte dei contenitori o per altri motivi pratici, riportano le informazioni su una fascetta, un cartellino o un foglio istruzioni allegati al prodotto (paragrafi 2 e 3 del Regolamento 1223/2009):
- precauzioni particolari per l’impiego
-
elenco degli ingredienti
-
per i cosmetici non preconfezionati o confezionati dal venditore su richiesta dell’ acquirente o preconfezionati in vista della loro vendita immediata (paragrafo 4 del Regolamento 1223/2009):
- etichetta completa.
È possibile prevedere etichette multilingua, ma per i prodotti destinati al mercato italiano tali informazioni devono comparire obbligatoriamente anche in lingua italiana e con dimensione dei caratteri di stampa equivalenti a quelle dei testi che figurano in altre lingue.
Consulta

I prodotti cosmetici possono essere messi a disposizione sul mercato solamente se il contenitore e l’imballaggio recano le seguenti indicazioni, in caratteri indelebili, facilmente leggibili e visibili:
- il nome o la ragione sociale e l’indirizzo completo della persona responsabile; se in etichetta vengono riportati più indirizzi, quello presso cui è tenuta a immediata disposizione delle Autorità competenti la documentazione informativa sul prodotto deve essere scritto in evidenza
- il contenuto nominale espresso in peso o in volume (obbligatoriamente in italiano), con possibili deroghe per i campioni gratuiti, per le monodosi e per gli imballaggi con un contenuto inferiore a 5 g o a 5 ml. Per gli imballaggi preconfezionati solitamente commercializzati per insieme di pezzi, il contenuto può non essere indicato, purché sull’imballaggio venga menzionato il numero di pezzi
-
la data di durata minima o data di scadenza, cioè la data entro cui il prodotto può essere utilizzato, se opportunamente conservato, ovvero entro cui mantiene inalterate le sue caratteristiche e continua a svolgere la sua funzione iniziale; tale data è preceduta dal simbolo:
 o dalla dicitura «Usare preferibilmente entro:».
o dalla dicitura «Usare preferibilmente entro:».
La data è indicata in modo chiaro e si compone, nell’ordine, del mese e dell’anno oppure del giorno, del mese e dell’anno. Se necessario, l’indicazione del periodo di scadenza è completata precisando anche le condizioni di conservazione che devono essere rispettate per garantire la validità del prodotto -
per i prodotti con durata minima superiore a trenta mesi, invece, non è necessario indicare in etichetta una data di scadenza, ma deve essere riportata un'indicazione relativa al periodo di tempo in cui il prodotto, una volta aperto il contenitore, può essere utilizzato senza effetti nocivi per il consumatore, preceduta dal simbolo rappresentante un barattolo aperto
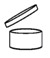 o dall’acronimo «PAO» (Period After Opening – periodo dopo apertura). Questo periodo è espresso in mesi e/o anni. Sono oggetto di possibili deroghe all’obbligo di riportare una data di scadenza o un PAO i prodotti monodose, i prodotti confezionati in modo tale da evitare il contatto tra il cosmetico e l’ambiente circostante (es. aerosol) e i prodotti per i quali il produttore certifichi che la formula è tale da impedire qualsiasi rischio di deterioramento a seguito di apertura del contenitore
o dall’acronimo «PAO» (Period After Opening – periodo dopo apertura). Questo periodo è espresso in mesi e/o anni. Sono oggetto di possibili deroghe all’obbligo di riportare una data di scadenza o un PAO i prodotti monodose, i prodotti confezionati in modo tale da evitare il contatto tra il cosmetico e l’ambiente circostante (es. aerosol) e i prodotti per i quali il produttore certifichi che la formula è tale da impedire qualsiasi rischio di deterioramento a seguito di apertura del contenitore
-
è obbligatorio scrivere in etichetta le precauzioni di impiego riportate negli Allegati tecnici da III a VI al Regolamento 1223/2009. Se del caso, devono essere riportate le eventuali indicazioni concernenti precauzioni particolari da osservare per i prodotti cosmetici di uso professionale. In caso di impossibilità pratica a riportare sul contenitore o sull’imballaggio esterno le precauzioni particolari per l'impiego, queste devono essere contenute in un foglio di istruzioni, una fascetta o un cartellino allegati al prodotto cosmetico. A tali indicazioni il consumatore deve essere rinviato mediante un'indicazione abbreviata o mediante il simbolo di rinvio

- il numero del lotto di fabbricazione o il riferimento che permetta di identificare il prodotto cosmetico; in caso di mancanza di spazio il numero di lotto può essere riportato solo sull’imballaggio
- il paese d’origine per i prodotti fabbricati in paesi extra UE. In questo caso è obbligatorio riportare «made in …»
- la funzione del prodotto cosmetico, salvo se risulta dalla sua presentazione
- l’elenco degli ingredienti, scritti secondo la denominazione comune degli ingredienti contenuta nel glossario stabilito dall'UE (Decisione di esecuzione (UE) 2022/677 della Commissione).
Come riportare gli ingredienti
Il glossario degli ingredienti deve tenere conto delle nomenclature riconosciute a livello internazionale, compresa la nomenclatura internazionale degli ingredienti cosmetici (INCI). Qualora non sia disponibile una denominazione comune per un determinato ingrediente, va impiegato un termine contenuto in una nomenclatura generalmente riconosciuta.
Gli ingredienti devono figurare in elenco preceduto dal termine “Ingredients”.
Non sono considerati ingredienti:
- le impurezze contenute nelle materie prime utilizzate
- le sostanze tecniche secondarie utilizzate nella miscela ma che non compaiono nella composizione del prodotto finito.
I composti odoranti e aromatizzanti e le loro materie prime sono riportati nell’elenco degli ingredienti con il termine generico di «parfum» o «aroma». Invece, le sostanze odoranti e aromatizzanti, che sono state definite come potenzialmente allergizzanti e la cui esplicita indicazione in etichetta è prescritta per legge, come riportato in Allegato III al Regolamento 1223/2009, sono riportate con le loro specifiche denominazioni nell’elenco degli ingredienti di seguito ai termini “parfum” e “aroma”. Alcuni ingredienti utilizzati nei composti odoranti e aromatici non presentano una denominazione INCI. I cosiddetti «nomi delle profumazioni» sono stati utilizzati nell’Unione per l’etichettatura dei prodotti cosmetici contenenti tali ingredienti.
Gli ingredienti sono indicati in ordine decrescente di peso al momento dell’incorporazione nel prodotto cosmetico. Gli ingredienti presenti in concentrazioni inferiori all’1% possono essere elencati in ordine sparso, dopo quelli presenti in concentrazioni superiori all’1%.
I coloranti diversi da quelli destinati a colorare le zone pilifere possono essere indicati in ordine sparso dopo gli altri ingredienti cosmetici.
Per i prodotti cosmetici da trucco immessi sul mercato in varie sfumature di colore, possono essere menzionati in una stessa etichetta tutti i coloranti, anche quelli diversi dai coloranti utilizzati nella gamma di colore specifica a cui l’etichetta si riferisce, a condizione di aggiungervi le parole «può contenere» o il simbolo «+/-». Il numero CI (Colour Index) figura nell’elenco quale denominazione comune degli ingredienti per i coloranti diversi da quelli destinati a colorare le zone pilifere.
Tutti gli ingredienti presenti sotto forma di nanomateriali sono chiaramente indicati nell’elenco degli ingredienti. La dicitura «nano», tra parentesi, segue la denominazione di tali ingredienti.
Gli ingredienti impiegati nei prodotti cosmetici devono essere riportati secondo la denominazione comune degli ingredienti contenuta nel glossario stabilito dall'UE (Decisione di esecuzione (UE) 2022/677 della Commissione).
Cosmetici non preconfezionati o confezionati al punto vendita
Il Decreto del Ministro della Salute del 27 settembre 2018 contiene all’articolo 3 commi 1, 2, 3 e 4 le Modalità di indicazione delle informazioni di cui all'art. 19 del Regolamento 1223/2009 per i cosmetici non preconfezionati o per i cosmetici confezionati dal venditore su richiesta dell'acquirente o preconfezionati in vista della loro vendita immediata.
Consulta
-
Decisione di esecuzione (UE) 2022/677 della Commissione del 31 marzo 2022 recante modalità di applicazione del regolamento (CE) n. 1223/2009 del Parlamento europeo e del Consiglio per quanto riguarda il glossario delle denominazioni comuni degli ingredienti da utilizzare nell’etichettatura dei prodotti cosmetici.
La precedente decisione (UE) 2019/701 è abrogata. -
Decreto del Ministro della Salute 27 settembre 2018
Procedure di controllo del mercato interno dei prodotti cosmetici, ivi inclusi i controlli dei prodotti stessi, degli operatori di settore e delle buone pratiche di fabbricazione, nonché degli adempimenti e delle comunicazioni che gli operatori del settore sono tenuti ad espletare nell'ambito dell'attivita' di vigilanza e sorveglianza di cui agli articoli 7, 21, 22 e 23 del regolamento (CE) n. 1223/2009 del Parlamento europeo e del Consiglio, del 30 novembre 2009, sui prodotti cosmetici. (G.U. Serie Generale, n. 273 del 23 novembre 2018) - Regolamento (CE) n. 1223/2009 del Parlamento Europeo e del Consiglio del 30 novembre 2009 sui prodotti cosmetici
Sperimentazione animale
La sperimentazione animale è vietata nell'UE per i prodotti cosmetici finiti dall'11 settembre 2004 e per gli ingredienti dei prodotti cosmetici dall'11 marzo 2009 (divieto di sperimentazione).
Dall'11 marzo 2009 è inoltre vietata l'immissione sul mercato dell'UE di prodotti cosmetici e loro ingredienti che siano stati oggetto di una sperimentazione animale, allo scopo di conformarsi alle disposizioni della normativa vigente (divieto di immissione sul mercato applicabile dal 2009). Tale divieto di immissione sul mercato aveva un'applicazione generale tranne che per gli effetti più complessi sulla salute umana che dovevano essere oggetto di sperimentazione per dimostrare la sicurezza dei prodotti cosmetici in assenza di sperimentazioni alternative non eseguite su animali (tossicità da uso ripetuto, tossicità riproduttiva e tossicocinetica). Il Parlamento europeo e il Consiglio avevano deciso che il divieto sarebbe entrato in vigore l'11 marzo 2013 (divieto di immissione sul mercato applicabile dal 2013).
Il divieto di immissione sul mercato è diventato pienamente applicabile dall'11 marzo 2013, indipendentemente dalla disponibilità di sperimentazioni alternative non eseguite su animali.
Cosa è possibile scrivere in etichetta
La persona responsabile può indicare sulla confezione del prodotto o su qualsiasi documento, foglio di istruzioni, etichetta, fascetta o cartellino che accompagna o si riferisce a tale prodotto cosmetico che il prodotto è stato sviluppato senza fare ricorso alla sperimentazione animale, solo a condizione che il fabbricante e i suoi fornitori non abbiano effettuato o commissionato sperimentazioni animali sul prodotto cosmetico finito, sul suo prototipo, né su alcun suo ingrediente e che non abbiano usato ingredienti sottoposti da terzi a sperimentazioni animali al fine di ottenere nuovi prodotti cosmetici.
Con la Raccomandazione del 7 giugno 2006 la Commissione europea aveva ribadito che l’uso di dichiarazioni su un prodotto cosmetico non deve trarre in inganno il consumatore. L'uso sull'etichetta della dicitura «non testato su animali» è un'informazione utile al consumatore in quanto serve a metterlo in condizione di poter scegliere il prodotto con piena cognizione di causa.
La Raccomandazione chiarisce, inoltre, che l'uso di tali dichiarazioni è volontario e che, tuttavia, chiunque dichiari sui prodotti cosmetici che essi non sono stati ottenuti attraverso sperimentazioni su animali deve assumersi la responsabilità della dichiarazione e deve essere in grado di provarne la pertinenza con riferimento alle disposizioni del Regolamento 1223/2009.
La forma della dichiarazione, l'immagine, il segno figurativo o altro per indicare che non si è fatto ricorso alla sperimentazione animale sono liberi, purché siano soddisfatte le prescrizioni della normativa comunitaria che autorizzano l'uso di tali dichiarazioni.
Un «prodotto per la protezione solare» è qualsiasi preparato (quale crema, olio, gel, spray) destinato a essere posto in contatto con la pelle umana, al fine esclusivo o principale di proteggerla dai raggi UV assorbendoli, disperdendoli o mediante rifrazione.
Le indicazioni relative all’efficacia dei prodotti per la protezione solare dovrebbero essere semplici e facilmente comprensibili e fondarsi su criteri identici al fine di aiutare il consumatore a confrontare e a scegliere il prodotto giusto per una data esposizione e per un determinato tipo di pelle (Raccomandazione della Commissione del 22 settembre 2006 sull’efficacia dei prodotti per la protezione solare e sulle relative indicazioni).
È necessario, in particolare, che le informazioni relative al grado di protezione dai raggi ultravioletti, sia UVA che UVB, siano riportate in maniera uniforme, per facilitare la scelta del prodotto.
Si consiglia, inoltre, per indicare il grado di protezione del prodotto, di utilizzare nell'etichettatura una delle quattro categorie:
- protezione "bassa"
- protezione "media"
- protezione "alta"
- protezione "molto alta".
L'indicazione della categoria permette di fornire un'informazione sull’efficacia dei prodotti più semplice e pertinente rispetto all'indicazione del fattore di protezione. La categoria dovrebbe pertanto figurare sull’etichetta in maniera altrettanto visibile del fattore di protezione solare.
Riguardo la gamma di numeri corrispondenti ai fattori di protezione solare riportati sulle etichette, la Commissione ha ritenuto che essa possa essere ridotta senza limitare la possibilità del consumatore di scegliere fra protezioni diverse.
La molteplicità di numeri utilizzati sulle etichette per indicare il fattore di protezione non contribuisce all’obiettivo di fornire indicazioni semplici e pertinenti. L’aumento di protezione da un numero al successivo è trascurabile, soprattutto nella fascia di fattori più elevata.
| Categoria indicata sull’etichetta | Fattore di protezione solare indicato sull’etichetta |
|---|---|
| Protezione bassa | 6 |
| 10 | |
| Protezione media | 15 |
| 20 | |
| 25 | |
| Protezione alta | 30 |
| 50 | |
| Protezione molto alta | 50+ |
In commercio possono essere presenti prodotti cosmetici in formulazioni sterili che sono confezionati in un contenitore primario in forma di fiala (ampoule) o flacone/flaconcino con tappo in gomma e ghiera (vial).
Questi prodotti possono essere destinati a uso professionale oltre che a un uso diretto da parte del consumatore.
Un prodotto cosmetico, anche se presentato come sterile e confezionato in un contenitore sterile della tipologia descritta (ad esempio fiala/flacone), non può e non deve essere iniettato.
Per evitarne l'uso improprio, tali prodotti immessi sul mercato e presentati come sterili non possono e non devono essere etichettati e pubblicizzati in modo tale da far ritenere possibile, ad un utilizzatore finale, l’impiego del prodotto per via iniettiva.
In etichetta tali prodotti devono riportare le precauzioni particolari per l’impiego: «solo per uso topico» e «non iniettare».












 Prodotti cosmetici, la notifica dei siti di produzione
Prodotti cosmetici, la notifica dei siti di produzione



